
T細胞受體TCR信號是調控T細胞免疫的決定性因素。TCR信號通過一系列精準調控的級聯轉導,激活并誘導關鍵轉錄因子AP-1, NFκB及NFAT的核轉位,從而活化T細胞,產生T細胞免疫效應。關于TCR信號如何經蛋白激酶PKCθ激活 AP-1一直是令人困惑的問題。揭開謎底,將幫助我們深入認識TCR信號的調控機制,并為更有效的免疫治療提供新視角。
核孔復合物(NPC)是跨核膜分布的蛋白復合物,它是目前已知的負責真核細胞核質雙向運輸唯一且具有選擇性的通道。其中,NPC的RanBP2亞復合物(RanBP2/RanGAP1-SUMO1/Ubc9)在形成跨核膜RanGTP濃度梯度及重裝轉運蛋白importin α/β入核復合物等中具有重要作用。通常認為,核孔復合物自主地介導細胞受體信號激活的轉錄因子入核,而對受體信號在調節核孔復合物中的作用知之甚少。
近日,我校生命科學學院李迎秋課題組研究首次揭示,人或鼠T細胞受到TCR信號刺激后,蛋白激酶PKC-θ直接磷酸化蛋白分子RanGAP1,促進RanBP2亞復合物組裝及入核轉運,從而引起AP-1的核轉位。研究發現,TCR信號刺激誘導PKC-θ與NPC發生共定位并磷酸化RanGAP1, 而將RanGAP1上的磷酸化位點突變成非磷酸化位點,則抑制TCR信號誘導的關鍵轉錄因子核轉位。究其原因,發現PKC-θ磷酸化RanGAP1增強其與SUMO化修飾中的綴合酶Ubc9結合,進而增強其SUMO化修飾,促進RanBP2亞復合物的組裝(見示意圖)。
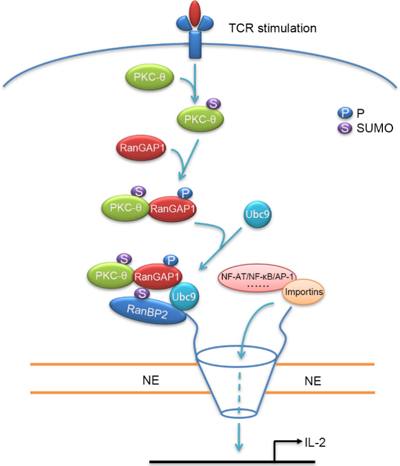
TCR-PKCq-RanGAP1信號軸調節轉錄因子核轉位的工作模型示意圖
綜上,這項研究發現了TCR信號經PKC-θ調節NPC的RanBP2亞復合物組裝,從而間接調控關鍵轉錄因子AP-1等的核轉位,解開了蛋白激酶PKCθ如何調節AP-1轉錄活性之謎。研究結果首次建立了免疫受體信號與核孔復合物組裝之間的直接聯系,揭示了TCR信號調控的新層面,為受體信號及核質轉運相關領域的研究及應用提供了重要參考。
研究成果“T-cell receptor (TCR) signaling promotes the assembly of RanBP2/RanGAP1-SUMO1/Ubc9 nuclear pore subcomplex via PKC-θ-mediated phosphorylation of RanGAP1”近日在國際知名學術期刊eLife在線發表。李迎秋教授為論文通訊作者,博士畢業生賀玉嬌為論文第一作者,博士后趙晨思、博士生肖智輝及碩士畢業生楊志國也做出了重要貢獻,美國LJI免疫研究所Altman Amnon教授參與了該項研究并給予了重要支持。該研究得到了國家自然科學基金等項目資助。